Коррозия сварных швов
 Интенсивность коррозии сварных соединений в первую очередь зависит от следующих факторов:
Интенсивность коррозии сварных соединений в первую очередь зависит от следующих факторов:
1) свойства сварочного и основного материала, свойства сварного шва (микро- и макронеоднородность, геометрическая неоднородность);
2) характер напряжений (остаточные напряжения и внешняя нагрузка);
3) агрессивность коррозионной среды;
4) наличие сварочных дефектов (непровары, подрезы, острые кромки, наплывы);
5) конструктивные особенности сварного соединения (концентраторы напряжений);
6) особенности технологии сварки.
Виды коррозионных разрушений сварных швов приведены на рис.1.

Рисунок 1 – Виды коррозии сварных швов: а – равномерная, б – сосредоточенная на шве, в – сосредоточенная на основном металле, г – в зоне термического влияния, д – межкристаллитная в зоне термического влияния, е – ножевая, ж – межкристаллитная на шве, з – точечная, и – коррозионное растрескивание, к – коррозионная усталость, л – растрескивание и усталость.
Стыковые сварные соединения имеют наименьшую концентрацию напряжений.
Разнородность материала шва приводит к коррозии электрохимического характера, когда один из участков шва становится анодом, а другой — катодом. При наличии агрессивной электролитической среды происходит растворение анодного участка. Каждая зона сварного соединения имеет свой электродный потенциал (рис.2). Чем отрицательнее соседние потенциалы и больше их разница, тем быстрее протекает процесс коррозии (таблица 1).
Таблица 1. Электродные потенциалы сварных швов в 3% растворе NaCl (для увеличения нажмите на рисунок)

Для уменьшения процесса коррозии сварных швов должно выполняться следующее условие: коэффициент коррозионной совместимости (отношение скорости коррозии анодного участка к скорости коррозии основного металла) должен быть меньше допустимого значения.
Структурные изменения в материале при сварке приводят к межкристаллитной коррозии. На интенсивность образования межкристаллитной коррозии сильное влияние оказывают частицы карбидов избыточных фаз металла.
Точечная коррозия сварных швов характерна для тех условий, когда нарушаются защитные пленки пассивирующихся металлов (алюминий и его сплавы, хромоникелевая сталь и т. д.).
Пластические деформации могут создавать как благоприятные условия для протекания коррозии (возникновение активных анодных зон в результате дефектов кристаллической решетки, наличие растягивающих напряжений), так и уменьшать коррозионные процессы (сжимающие напряжения на поверхности металла, более равномерное распределение анодных зон, уменьшение их локализации).
«Щелевая» коррозия может возникнуть при наличии концентраторов напряжений, приводящих к растрескиванию материала. Форма и глубина концентраторов (типа щелей, либо открытого типа) существенно влияют на коррозионное разрушение. Наиболее опасные щелевые концентраторы могут возникнуть в результате непровара сварного шва. В вершине непровара электродный потенциал становится более отрицательным, чем основной металл, что и приводит к интенсивной коррозии.

Рисунок 2 – Потенциалы различных зон сварного шва: Еш – потенциал шва, Езтв – потенциал зоны термического воздействия, Ем -потенциал зоны основного металла, Еуст – установившийся потенциал сварного соединения.
В зависимости от характера возникновения коррозии существуют различные методы борьбы с ней:
1. Общие методы: применение новых коррозионно-стойких материалов и более рациональная проработка конструкции; использование защитных покрытий; ингибирование среды и электрохимическая защита.

Рациональное конструирование сварных соединений включает в себя исключение конструктивных концентраторов напряжений, уменьшение количества сварных швов в высоконапряженных участках конструкции, уменьшение зон остаточных напряжений, ужесточение допусков на дефекты сварных швов.
2. Улучшение сварочных режимов и ликвидация сварочных дефектов: применение предварительного, сопутствующего или последующего подогрева свариваемых деталей для уменьшения скорости их охлаждения; применение специальных присадочных материалов; ультразвуковая обработка; термомеханическая обработка; наложение дополнительных валиков; поперечные колебания дуги при сварке. Уменьшение скорости охлаждения помогает снизить структурную неоднородность и остаточные напряжения (рис. 3).

Рисунок 3 – Влияние скорости охлаждения сварного шва: 1 – на степень неоднородности металла, 2 – на структурную неоднородность, 3 – на сопротивляемость коррозии.
3. Для уменьшения межкристаллитной коррозии шва применяют следующие способы: снижают содержание углерода менее предела его растворимости в аустенитной фазе; добавляют титан и ниобий; увеличивают скорость охлаждения в области критических температур, предотвращая выпадение карбидов.
4. Зачистка сварных швов и нанесение защитных покрытий для ликвидации точечной коррозии.
5. Для уменьшения остаточных напряжений — снижение объема метала, участвующего при сварке; создание обратных деформаций; компенсация деформаций симметричным наложением швов; создание условий для свободной усадки при сварке; предварительный и последующий нагрев; механическое воздействие на шов после сварки (проковка шва, прокатка зоны сварного шва, обкатка роликами, обработка взрывом); приложение обратной статической нагрузки к конструкциям.
Теоретические основы дуговой и электрошлаковой сварки
При контактировании с агрессивной средой сварные соединения в процессе эксплуатации могут по-разному противостоять коррозии (разъеданию) металла. Чаще всего сварные соединения претерпевают химическую и электрохимическую коррозию.
Химической коррозией называется коррозия, сопровождающаяся образованием химических соединений с металлом при непосредственном воздействии соприкасающейся с ним среды, (например, сухого воздуха) без появления электрического тока.
Примером химической коррозии является окисление железа на воздухе при нагреве с образованием окислов (окалины) на его поверхности или образование гидроокиси железа в присутствии дистиллированной воды.
Пленки окислов железа непрочны, сплошность их легко нарушается и Железо (сталь) продолжает окисляться вглубь. Некоторые металлы (алюминий, высокохромистые стали и др.) при окислении образуют сплошные прочные пленки окислов, плотно прилегающие к поверхности металла и предохраняющие его от дальнейшего окисления.
Вместе с тем оксидные пленки на железе и стали, образуемые при определенных условиях (воронение в горячих растворах щелочей в присутствии окислителей), могут также защищать металл от дальнейшего окисления в коррозионномягких условиях (например, на воздухе).
Электрохимической коррозией называется коррозия в электролитах, сопровождающаяся появлением электрического тока. Электролитами могут быть кислоты и их растворы, щелочи и их растворы, растворы солей в воде (в том числе морская вода), а также вода, содержащая растворенный воздух.
При погружении металла в электролит положительные ионы, находящиеся на поверхности металла, будут переходить в раствор в количестве, зависящем от природы металла и электролита. Различные металлы обладают различной растворимостью в электролите, т. е. имеют различный электрохимический потенциал.
Электрохимический потенциал представляет собой величину, пропорциональную энергии перехода иона металла в электролит при данных условиях. Чем отрицательнее электрохимический потенциал металла в данном электролите при данных условиях, тем легче он растворяется в электролите.
Если два соединенных вместе различных металла опустить в электролит, то образуется гальваническая макропара с определенной разностью электрохимических (электродных) потенциалов. При этом один металл, обладающий более низким электрохимическим потенциалом, будет анодом, а второй (с более высоким потенциалом) — катодом.
Переходящие с анода в раствор (в электролит) положительные ионы металла (ион-атомы) сообщают раствору положительный заряд, а освободившиеся и оставшиеся в металле избыточные электроны заряжают анод отрицательно.
Вследствие избытка зарядов (образования электрического поля) в металле и в электролите возникает электрический ток: электронный в металле и ионный в электролите.
Отметим, что электропроводность жидких растворов (электролитов) обусловлена диссоциацией (распадом) молекул раствора на ионы: положительно заряженные — катионы и отрицательно заряженные — анионы. Под воздействием электрического поля катионы (+) перемещаются в электролите к катоду, а анионы (—) — к аноду и разряжаются.
При возможности беспрепятственного разряжения (нейтрализации) катионов на катоде за счет перешедших сюда электронов процесс будет протекать беспрерывно.
Вследствие того что из анода в раствор переходят материальные частицы металла (ион-атомы), происходит его разрушение (коррозия) — непрерывная потеря массы. Второй металл (катод) в этих условиях (в присутствии анода) в электролите не растворяется.
Аналогичное явление электрохимической коррозии может наблюдаться при соприкосновении с электролитом металла, имеющего двухфазную структуру.
В случае различных электрохимических потенциалов структурных фаз в условиях контактирования металла с электролитом он будет представлять большое количество гальванических микропар. Зерна фазы (или пограничные слои зерен), обладающие более отрицательным электродным потенциалом, оказавшись анодом, будут при этом подвергаться коррозии.
Стойкость против коррозии зависит от химического состава стали или другого металла, его структуры, состояния поверхности, напряжений в нем, химического состава, концентрации и температуры агрессивной среды, а также скорости перемещения этой среды по поверхности металла.
В зависимости от рабочей среды для изготовления сварных изделий и сооружений используют соответствующие стали или другие металлы (алюминий, титан, их сплавы и др.). Основной задачей сварщиков при этом является обеспечение равенства коррозионной стойкости различных участков соединения (шва, околошовной зоны и основного металла вдали от шва).
Нередки случаи, когда в результате неправильно выбранной технологии сварки металл шва оказывается менее коррозионностойким, чем свариваемая сталь.
Так, например, сварные швы, выполненные вручную на низколегированной хромокремненикелемедистой стали типа СХЛ (10ХСНД) низкоуглеродистыми электродами, сильно разрушаются в морской воде под действием коррозии.
Коррозия этих швов вызвана более низким содержанием в них хрома и никеля по сравнению с основным металлом. Электрохимический потенциал нелегированного шва ниже, чем легированного основного металла, и в макропаре с основным металлом при наличии электролита (морской воды) шов оказывается анодом, что и обусловливает интенсивную его коррозию.
Легирование металла шва хромом в количество 0,7— 1,0% повышает его электрохимический потенциал и коррозионную стойкость до уровня основного металла.
На рис. 44 показано влияние содержания хрома в металле шва на коррозию сварных соединений из стали 10ХСНД в морской воде. Глубина коррозии и относительная стойкость сварных швов с различным содержанием хрома за 1000 ч испытания характеризуются данными, приведенными в табл. 9.

Рис. 44. Влияние содержания хрома в металле шва на коррозию сварных соединений из стали 10ХСНД в морской воде при температуре 50°С за 1000 ч.
Таблица 9. Глубина коррозии и относительная стойкость шва в зависимости от содержания в нем хрома.
Содержание хрома в шве, %
Глубина коррозии шва, мм
Относительная стойкость шва (стойкость основного металла принята равной 1)
Повреждений металла и сварных соединений
Много сварных конструкций эксплуатируются в условиях действия активных рабочих и внешних сред, которые могут существенно влиять на механические свойства сварных соединений, и для обеспечения высокой конструкционной прочности изделия требуется проведение дополнитель-ных конструктивных и технологических мероприятий. Статистика отказов сосудов давления, обычных и атомных энергетических установок пред-ставлена в табл.9.1  и наглядно демонстрирует значительную роль кор-розионной среды в возникновении и развитии разрушений.
и наглядно демонстрирует значительную роль кор-розионной среды в возникновении и развитии разрушений.
Таблица 9.1 – Статистика отказов сосудов давления
| Причины отказов | Количество отказов к полному количеству отказов, % |
| Обычные сосуды | Атомные установки |
| Механическая или термическая усталость | |
| Коррозионно-механическая усталость | |
| Дефекты производства | |
| Другие |
Склонность сварных конструкций к разрушению при одновременном влиянии механических нагрузок и активных сред зависит от следующих факторов:
– степени электрохимической активности металла разных зон свар- ного соединения, определяющей его термодинамическую неустойчивость;
– напряженного состояния металла, реализующего механическое разрушение;
– агрессивности коррозионной среды, зависящей от ее ионного сос-тава, рН-свойств, газонасыщенности, температуры, давления и других па-раметров.
Одним из существенных факторов влияния внешней среды на проч- ность металлов и сварных соединений является коррозионное влияние. На-иболее распространенными средами, оказывающими коррозионное воз-действие являются: влажный воздух, вода и водные растворы солей и ще-лочей, разные химические среды в химическом производстве.
Коррозия – это разрушение металлов вследствие химического или электрохимического взаимодействия их со средой.
Химическая коррозия – это образование соединений в средах, кото- рые не проводят электрический ток (прямое соединение металла с агрес-сивными составляющими среды).
Электрохимическая коррозия – это произвольное разрушение метал-ла вследствие электрохимического взаимодействия с электролитически проводящей средой, при котором ионизация атомов металла (анодная ре-акция) и восстановление оксидного компонента коррозионной среды (ка-тодная реакция) протекают не в одном акте. Ионы металла направляются из анодных участков поверхности в раствор (анодный процесс), оставляя в металле электроны, которые перемещаются к катодному участку, где за-бираются каким- либо содержащимся в растворе ионом или атомом, спо-собным восстанавливаться на катоде. Разрушаются анодные участки, име-ющие более отрицательный в данной среде заряд.
Механизм коррозионных разрушений сварных соединений принци-пиально не отличается от механизма разрушений основного металла. Од-нако сварные соединения имеют большую неоднородность, которая вы –
звана расхождением химического состава, структуры отдельных зон, гео-метрией соединения, остаточными напряжениями и пластическими дефор-мациями. Наибольшее влияние коррозионной среды отмечается в тех слу-чаях, когда в сварных конструкциях действуют остаточные напряжения.
На рисунке 9.1  приведены основные виды коррозионных повреж-дений металла.
приведены основные виды коррозионных повреж-дений металла.

а – общая равномерная; б – местная;
в – межкристаллическая; г – коррозионное растрескивание
Рисунок 9.1 – Виды коррозионных повреждений основного металла
Это общая равномерная коррозия (а), местная коррозия в виде отде-льных язв и углублений (б), межкристаллическая коррозия (МКК), вызы-вающая разрушение по границе зерен (в). Указанные виды коррозионного повреждения приводят в основном к уменьшению несущего сечения дета-ли и созданию концентраторов напряжений вследствие изменения геомет-рической формы поверхности. Имеют место виды коррозионного повреж-дения, которые изменяют сопротивление металла разным видам нагрузки. Например, с образованием в металле сетки мелких трещин появляется так называемая коррозионная хрупкость. Под влиянием коррозионной среды может снизиться сопротивление усталости или сопротивление продвиже-нию трещины, что ведет к снижению критерия интенсивности напряже-ний К.
Опасным видом коррозионного разрушения является коррозионное растрескивание, когда в напряженном металле при наличии агрессивной среды появляется трещина от гладких поверхностей металла(рис. 9.1, г).
Основные виды коррозионных повреждений сварных соединений приведены в таблице 9.2  .
.
Таблица 9.2 – Основные виды коррозионных повреждений сварных
| Тип коррозии | Вид коррозии | Характер разрушения |
| Общая | Равномерная сварного соединения |  |
| Равномерная основного металла |  | |
| Сосредоточенная на шве |  | |
| Сосредоточенная в зоне термического влияния |  | |
| Местная | Межкристаллитная структурная : | |
| в зоне термического влияния |  | |
| в сварном шве |  | |
| ножевая |  | |
| Точечная питтинговая язвенная |  | |
| Под напряжением | Коррозионное растрес-кивание (межкристал-литное и транскристал-литное разрушение) |  |
| Коррозионная усталость (межкристаллитное и транскристаллитное разрушение) |  |
Коррозия может быть общая и местная. Общая коррозия может быть равномерной в границах всего сварного соединения, включая и основной металл. Это случаи, когда процесс сварки оказывает очень слабое влияние на коррозионную стойкость. Если отрицательное влияние отсутствует, а металл шва является даже более стойким, чем основной металл, то наблю-дается равномерная коррозия основного металла. Напротив, если шов ме-нее стоек в сравнении с основным металлом, то коррозия сосредоточена в шве. Слабыми участками в отношении общей коррозии могут быть зоны термического влияния. Тогда коррозия будет сосредоточена в них. Сосре-доточение общей коррозии на шве или в околошовной зоне является опасным видом разрушения, свидетельствующим о заметном отрицатель-ном влиянии процесса сварки.
Местные виды коррозии характерны для сварных соединений неко-торых легированных сталей и цветных металлов. Например, структурная межкристаллитная коррозия типична для аустенитных и хромоникеле-вых сталей. Она может происходить в зоне, нагревавшейся до 600…900 о С, в шве, а также в узкой зоне, примыкающей к шву, которая нагревалась при сварке свыше 1250 о С. Последний вид получил название ножевой коррозии. Точечная коррозия может возникать вследствие повреждения поверхност-ной пленки металлов во время нагрева при сварке.

1 – основной металл; 2– ручная дуговая сварка;
3– сварка под флюсом; 4 – сварка в СО2 ;
5 – аргонодуговая сварка
Рисунок 9.2 – Средняя скорость коррозии сварных образцов (шов и зона
термического влияния) в атмосферных условиях за 3 года
Из данных рисунка 9.2 вытекает, что влияние разных видов сварки на общую коррозию сварных соединений из стали Ст.3 в атмосферных ус-ловиях приблизительно одинаково. В сплаве АМг-6Н сварное соединение имеет заметно меньшую стойкость в сравнении с основным металлом.
Геометрические особенности сварного соединения также влияют на коррозию. На рисунке 9.3 [  ] приведены данные коррозии кольцевых сва-рных соединений труб (сталь Х18Н10Т) с непроваром в корне шва. Испы-тания выполнялись в азотной кислоте при температуре 30. 50 о С, при дав-лении в системе 50 атм (5 МПа) по ускоренной методике на протяжении двух лет, что соответствовало 9 годам эксплуатации. Увеличение ширины непровара до 0,25 мм усиливает коррозию. При значительных величинах непровара дальнейшее возрастание коррозии замедляется. Глубина непро-вара способствует усилению коррозионного разрушения.
] приведены данные коррозии кольцевых сва-рных соединений труб (сталь Х18Н10Т) с непроваром в корне шва. Испы-тания выполнялись в азотной кислоте при температуре 30. 50 о С, при дав-лении в системе 50 атм (5 МПа) по ускоренной методике на протяжении двух лет, что соответствовало 9 годам эксплуатации. Увеличение ширины непровара до 0,25 мм усиливает коррозию. При значительных величинах непровара дальнейшее возрастание коррозии замедляется. Глубина непро-вара способствует усилению коррозионного разрушения.

А б
1 – глубина непровара 10 . 20%; 2 – 20 . 30%;
3 – 30 . 40%; 4 – 40 . 50%; 5 – 50 . 60%; 6 – 60. 70%;
7 – ширина непровара 0 . 0,5мм; 8 – 0,05. 0,5мм; 9- 0,5..1,0мм
Рисунок 9.3 – Влияние ширины непровара (а) и глубины непровара (б)
на глубину коррозии
Собственные и эксплуатационные напряжения влияют на общую и местную коррозию. Растягивающие напряжения увеличивают скорость об-щей коррозии металлов в кислых средах и незначительно – в нейтральных и основных средах. Более существенно влияние напряжений на местные виды коррозии.
К отдельному типу коррозионного повреждения относят коррозион-ное растрескивание и коррозионную усталость под напряжением (см.табл.9.2). Типичными средами, в которых происходит растрескивание сварных соединений, являются: для углеродистых сталей – растворы щело-чей и нитратов; для нержавеющих сталей – хлориды; для алюминия и его сплавов – растворы солей; для титановых сплавов – растворы неорганиче-ских кислот.
В сварных соединениях кроме собственных напряжений присутству-ет значительное количество других факторов, оказывающих влияние на коррозионное растрескивание (это пластическая сварочная деформация, химическая и структурная неоднородность, наличие разных дефектов и др.). На рисунке 9.4  показано влияние уровня эквивалентного напря-жения sі, возникающего в круглом образце с круговым швом от окружных st и радиальных sr напряжений, на время до растрескивания:
показано влияние уровня эквивалентного напря-жения sі, возникающего в круглом образце с круговым швом от окружных st и радиальных sr напряжений, на время до растрескивания:
 (9.1)
(9.1)

σі остаточное, МПа σвн, МПа а б
а – без внешней нагрузки: 1 – Х18Н10Т, кипящий 42% -ный раствор хлористого магния; 2 – ВТ-1-1, раствор: 2,5% брома, 15% воды, осталь-ное – метиловый спирт, 18 о С; 3 – ВТ- 4, раствор: 2,5% брома, 5% воды, остальное –метиловый спирт, 18 о С; 4 – сталь Ст.3, кипящий раствор нитратов: 45 % Са(NО3)2 + 35%NH4NO3;
б – при внешней двухосевой нагрузке σвн: 1 и 4 – без собственных напряжений; 2 и 3 – с начальными напряжениями; 1 и 2 – сталь Х18Н10Т, кипящий 42% – ный раствор хлористого магния; 3 и 4 – ВТ-4, раствор: 2,5% брома, 15% воды, остальное – метиловый спирт
Рисунок 9.4 – Влияние остаточных сварочных напряжений на
коррозионное растрескивание при двухосевом напряженном состоянии
При испытании образцов из титановых сплавов (кривые 2 и 3) раз- личные уровни напряжений sі достигались выбором соответствующих ди-аметров швов, вызывающих необходимые напряжения sr и st. Для сталей Х18Н10Т и Ст.3 (кривые 1 и 4) различный уровень напряжений был полу-чен последующим отпуском. Однако опыты показали, что отпуск не ока-зывал заметного влияния на коррозионное растрескивание, поэтому пред-ставленные результаты рассматриваются как зависящие от уровня собст-венных напряжений, с увеличением которых резко снижается время до растрескивания. Вероятно, существует некоторый невысокий уровень на-пряжений, при котором растрескивание не может наступить в пределах довольно значительных выдержек. Влияние собственных напряжений, вызванных сваркой, хорошо просматривается на рис.9.4,б. Приложение внешних нагрузок к образцам без собственных напряжений (кривая 1) и с начальным собственным напряжением (кривая 2) приводит к растрески-ванию после различной продолжительности выдержки.
Пластическая деформация в зависимости от схемы ее создания и ве-личины влияет на коррозионное растрескивание. На рис.9.5  показана зависимость времени до растрескивания от величины пластической дефор- мации, созданной при разных температурах. Величины пластических де-формаций до 2. 3% наиболее неблагоприятно влияют на прочность.
показана зависимость времени до растрескивания от величины пластической дефор- мации, созданной при разных температурах. Величины пластических де-формаций до 2. 3% наиболее неблагоприятно влияют на прочность.

Рисунок 9.5 – Влияние пластической деформации  , температуры на
, температуры на
коррозионное растрескивание при напряжении σ = 0,8σТ стали Ст.3, находящейся в кипящем растворе нитратов:
КОРРОЗИОННАЯ стойкость И ПРОЧНОСТЬ СВАРНЫХ СОЕДИНЕНИЙ
Виды и особенности коррозионных разрушений металлических, в том числе сварных, конструкций определяются свойствами материала, напряженным состоянием в конструкции, свойствами коррозионной среды и условиями взаимодействия металла со средой (температурой, временем, условиями контактирования, давлением и др.). Механизм коррозионных разрушений сварных соединений не отличается от механизма разрушений основного металла. Особенности, которые определяют (в отличие от основного металла) причины, характер, кинетику и механизм разрушений сварных соединений, зависят от физико-химического воздействия сварки, вызывающего неблагоприятное изменение и неоднородность свойств металла и напряженного состояния, следствием чего является усиление отрицательного воздействия среды.
Для сварного соединения характерны: а) структурно-химическая макро — и микронеоднородность (основной металл, литой металл шва, переходные структурные зоны влияния; зерна, границы зерен, фазы включения и т. д. в пределах каждой зоны); б) неоднородность напряженного состояния собственного (остаточные напряжения и пластическая деформация) и от внешней нагрузки; в) геометрическая неоднородность (технологические и конструктивные концентраторы). Эти основные виды неоднородности определяют механическую, физическую и электрохимическую макро — и микронеоднородность сварных соединений (рис. 1) и особенности коррозионных разрушений сварных соединений (рис. 2).
По механизму различают коррозию химическую и электрохимическую. Химическая коррозия представляет собой процесс взаимодействия металла с агрессивным компонентом среды (сухими газами, неэлектролитами) по реакции Me -+- х -*■ Me х. Электрохимическая коррозия — процесс самопроизвольного разрушения металла в результате электрохимических реакций, скорость которых определяет скорость коррозии: а) анодной реакции — перехода ионов металла Ме+ в раствор с оставлением эквивалентного количества п электронов е в металле; Ме°—пе-+ МеЛ+, определяющей материальные потери при коррозии; б) катодной реакции—процесса восстановления окислительных компонентов среды D (Н+, 02, Cl2, Br2, NOJ, и др.) за счет присоединения появившихся в металле избыточных электронов (процесс деполяризации D + пе -> (Dne); в) процесса перетекания электронов по металлу и соответствующего перемещения катионов (+) и анионов (—) в растворе, т. е. коррозионного тока [1]. В подавляющем большинстве сред процесс коррозии является электрохимическим.
По виду коррозионных разрушений различают общую (сплошную) коррозию (равномерную, неравномерную, избирательную); местную (локализованную в виде язв, точек, под поверхностью, межкристаллитную); растрескивание под действием статических и циклических нагрузок.
Особенности общей электрохимической коррозии сварных соединений связаны с электрохимической неоднородностью двух видов: а) макронеоднородностью, обусловленной различием химического состава и структуры в разных зонах соединения; б) микронеоднородностью, обусловленной структурной и химической неоднородностью в пределах каждой зоны (рис. 3). Поэтому в коррозионном отношении сварное соединение представляет собой сложную многоэлектродную короткозамкнутую электрохимическую систему, характерными макро
электродами которой являются шов, зона термического влияния с серией переходных структур, основной металл (табл. 1).
Макронеоднородность оценивается по величине средних электродных потенциалов ф каждой зоны, микронеоднородиость — по величине локальных элек-
Рис. 1. Неоднородность сварных соединений в поперечном сечении:
а — максимальные температуры; 6 — схемы сварного соединения; в — твердости HV, НВ, величина ц зерна и плотность ц окисной пленки; г — механические свойства при изгибе; Р — несущая нагрузка, кгс; а — угол изгиба; д — электродный 0, Дф/ -> 0, — коррозия но преимущественно макрогетерогенноэлектрохимическому механизму. Определение чр и Дф» позволяет в первом приближении судить о неустойчивости различных зон
Рис. 3. Схемы коррозии сварного соединения:
/ — характерное распределение начальных макропотенциалов в сварном соединении; Фш — электродный потенциал шва;
электродный потенциал зоны термического влияния; фм — электродный потенциал основного металла; Фуст — установившийся стационарный потенциал заполяризованной системы шов — зона термического влияния (з. т.в.) — основной металл; II — макроэлектрохимическая коррозия, макропара основной металл — зона термического влияния, макропара зона термического влияния — шов, макропара основной металл — шов с зоной термического влияния; III — коррозия саморастворения каждой зоны: / — гетероген
ный механизм электрохимической коррозии; 2 — гомогенный механизм электрохимической коррозии; 3 — химическая коррозия и всего соединения в целом; б) Дф -> 0, Дф/ >0 — коррозия по преимущественно микроэлектрохимическому механизму; в) Дф > 0, Дф/ >0 — смешанный механизм коррозии.
Общая (сплошная) электрохимическая коррозия характерна для сварных конструкций из углеродистых и низколегированных сталей в большинстве природных сред (атмосфере, водных средах, почве).
Местные избирательные виды коррозии характерны для сварных соединений высоколегированных сталей и цветных металлов в средах, в которых металл
I. Электродные потенциалы различных зон сварных соединений в 3%-ном NaCl
Электродный потенциал, мВ
Зона термического влияния
Ручная дуговая, электрод
Ручная без присадки,
Аргонодуговая без при-
Аргонодуговая без при-
находится в пассивной и пассивно-активной области. Межкристаллитная коррозия, связанная со структурными изменениями в сталях, характерна при воздействии на них нагрева до критических температур 450—900° С для аустенитных и выше 900° С для высокохромистых ферритных сталей. Примером является межкристаллитная коррозия сварных соединений аустенитных хромоникелевых сталей, подробно рассмотренная в работе [6]. Разрушение развивается в трех зонах: в основном металле, нагреваемом при сварке до 500—900° С, в сварном шве и в основном металле вблизи линии сплавления в узкой зоне, нагреваемой до температур свыше 1200—1250° С (ножевая коррозия). Преимущественное разрушение границ зерен обусловлено электрохимической неоднородностью металла, возникающей при определенных для каждого сплава температурно-временных условиях в связи с выделением избыточных фаз. Если избыточные фазы образуют протяженные цепочки по границам зерен, то коррозионное разрушение приобретает чрезвычайно опасный межкристаллитный характер. Наиболее характерными избыточными фазами коррозионно-стойких сталей, практически постоянно в них присутствующими, являются карбиды. В зависимости от химического состава стали и условий термического воздействия на них образуются карбидные фазы [2] следующих типов: МС (Мє Ті, Nb, W, Zr, Та); M2C (MeW, Mo); M3C (на основе железа); MfCgnM^Q (на основе хрома), М^М^С(M’eFe, Ni, Со, Si; M”geW, Мо, Та, V, Cr, Nb); часто п + т = 6; М12С. Наряду с карбидными возможно образование других фаз, представляющих собой соединения компонентов стали с неметаллами (нитриды, карбонитриды, сульфиды, бориды и др.), а также интер — металлидкых фаз (о, л/), ряд фаз типа Лавеса (Fe2Mo, FeaW, Fe2Nb), упрочняющих фаз [M3Ti, М3А1) и др.
Принципиальная схема влияния температурно-временных условий на выделение карбидов и межкрисгаллитную коррозию показана на рис, 4. Темпера
туры 850° С благоприятны для преимущественного выделения М23Сб (кривая /). Ножевая коррозия связана с выделением цепочки карбидов стабилизирующих ■элементов (МС) под действием высоких температур (> 1200—1250° С) по границам зерен (околошовной зоны). Так как скорость коррозии (кипящая 56%-ная HN03) карбида титана примерно в 1000 раз, а карбида ниобия в 3—4 раза больше, чем скорость коррозии стали, то происходит избирательное растворение частиц карбидов, расположенных по границам зерен при катализирующем действии ■этого процесса на растворение прилегающих участков стали. Дополнительное тепловое воздействие в области критических температур (наложение второго шва) приводит к выделению карбидов хрома (М23С6), что усложняет механизм ножевой коррозии и повышает ее скорость. В окислительных средах кислотостойкие хромоникелевые стали, стабилизированные титаном, менее стойки, чем
стабилизированные ниобием, которые, в свою очередь, менее стойки, чем с низким содержанием углерода.
Межкристаллитная коррозия алюминиевых сплавов также связана с выпадением избыточных (интерметаллидных) фаз типа CuA12, Mg2Al3, MgZn2 и др.
Точечная коррозия типична для пассивирующихся металлов (хром, алюминий, хромоникелевые стали и др.) и возникает в результате повреждения в отдельных участках пассивной пленки. В сварных соединениях точечной коррозии подвержена преимущественно зона термического влияния.
Коррозионное разрушение сварных соединений
в напряженном состоянии [4]. Напряженное состояние влияет на коррозионное поведение металла вследствие: а) сообщения металлу добавочной энергии, в связи с чем иону Ме+ легче покинуть решетку деформированного металла по сравнению с неде- формированным; б) нарушения под действием деформации сплошности и защитных свойств поверхностных пленок; в) повышения степени неоднородности, связанной с появлением под действием деформаций дефектов кристаллической решетки и новых анодных фаз.
Скорость коррозии q относительно мало изменяется под влиянием упругих напряжений в нейтральных и щелочных средах, но может заметно (в 2—3 раза) увеличиваться в кислых средах пропорционально напряжениям: q = q0 — f — а о, где — скорость без растягивающих напряжений; а — коэффициент пропорциональности. Незначительно влияя на общую коррозию, напряжения интенсифицируют местные виды коррозии, наиболее опасными из которых является растрескивание, вызываемое статическими нагрузками, и коррозионная усталость при циклическом нагружении.
Коррозионное разрушение в напряженном состоянии определяется коррозионными, механическими и сорбционными процессами, а также сопутствующими процессами (кавитация, радиация). Коррозионное растрескивание состоит из двух основных периодов: а) зарождения трещины или инкубационного периода (С), в течение которого на металлической поверхности под влиянием локализации коррозионного процесса и растягивающих напряжений происходит зарождение первичных коррозионно-механических трещин; б) периода развития трещины (/р), который, в свою очередь, определяется временем докритического (субкритического) роста трещины до ее критических размеров, после чего происходит лавинообразное разрушение. Скорость субкритического роста коррозионных трещин в зависимости от материала, напряжений и среды изменяется в пределах 10—10_б мм/ч,
Постоянное разрушение пленки и интенсивное перемещение раствора при циклическом нагружении может резко повысить скорость разрушения при коррозионной усталости по сравнению с коррозионным растрескиванием.
Рис. 5. Влияние напряжений и вида напряженного состояния на коррозионное растрескивание в различных средах (сплошные линии — сварное соединение, штриховые — основной металл):
а — овн > 0, О, (Тост > 0; 1 — 12 XI8Н ЮТ; 2 — ОТ4; среды —- см. табл. 3
Разрушения вызываются растягивающими напряжениями. Для большинства сочетаний металл—среда имеются пороговые значения напряжений апор, ниже которых растрескивание не имеет места вообще или на определенной базе испытаний (рис. 5). Пороговые напряжения варьируются в пределах (0,2—1)ат (табл. 2). Сварные соединения растрескиваются интенсивнее по сравнению с основным металлом в связи с воздействием сварочного процесса. Остаточные сварочные напря-
2. Ориентировочные значения отношения пороговых напряжений к пределу текучести некоторых материалов в характерных средах, вызывающих их растрескивание
Виды и особенности коррозионных разрушений сварных соединений
Сообщение об ошибке
Виды и особенности коррозионных разрушений сварных соединений
Виды и особенности коррозионных разрушений металлических, в том числе сварных, конструкций определяются свойствами материала, напряженным состоянием в конструкции, свойствами коррозионной среды и условиями взаимодействия металла со средой (температурой, временем, условиями контактирования, давлением и др.). Механизм коррозионных разрушений сварных соединений не отличается от механизма разрушений основного металла. Особенности, которые определяют (в отличие от основного металла) причины, характер, кинетику и механизм разрушений сварных соединений, зависят от физико-химического воздействия сварки, вызывающего неблагоприятное изменение и неоднородность свойств металла и напряженного состояния, следствием чего является усиление отрицательного воздействия среды.
Для сварного соединения характерны:
- а) структурно-химическая макро- и микронеоднородность (основной металл, литой металл шва, переходные структурные зоны влияния; зерна, границы зерен, фазы включения и т. д. в пределах каждой зоны);
- б) неоднородность напряженного состояния собственного (остаточные напряжения и пластическая деформация) и от внешней нагрузки;
- в) геометрическая неоднородность (технологические и конструктивные концентраторы).
Эти основные виды неоднородности определяют механическую, физическую и электрохимическую макро- и микронеоднородность сварных соединений (рис. 1) и особенности коррозионных разрушений сварных соединений (рис. 2).

Рис. 1. Неоднородность сварных соединений в поперечном сечении: а – максимальные температуры; б – схемы сварного соединения; в – твердости HV, HB, величина μ зерна и плотность η окисной пленки; г – механические свойства при изгибе; Р – несущая нагрузка, кгс; α – угол изгиба; д – электродный φ и термоэлектрический Е потенциалы, мВ; е – остаточные пластические продольные εxy и поперечные εyy деформации; ρ – ориентировочная плотность дислокаций; ж – остаточные продольные σxy и поперечные σyy напряжения, кгс/мм 2 :
1 – СтЗсп; 2 – 12Х18Н10Т; 3 – ВТ1-1; 4 – АМг6, δ = 3 мм, аргонодуговая сварка вольфрамовым электродом
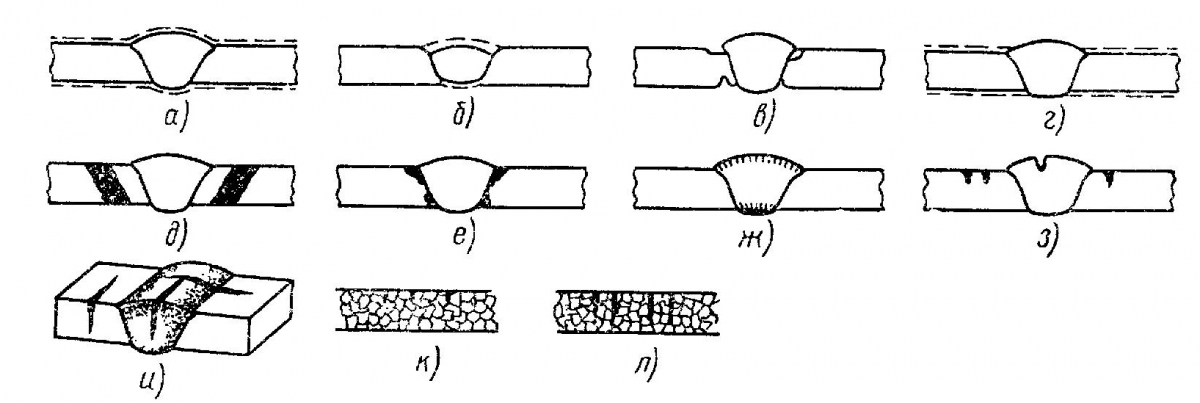
Рис. 2. Виды разрушений сварных соединений: а – г – соответственно общая коррозия: равномерная, сосредоточенная на шве, сосредоточенная в зоне термического влияния, преимущественно основного металла; д – з – соответственно местная коррозия: межкристаллитная в зоне термического влияния, ножевая в зоне сплавления, в сварном шве и точечная; и – л – коррозионное растрескивание и усталость меж- н транскристаллитные
По механизму различают коррозию химическую и электрохимическую. Химическая коррозия представляет собой процесс взаимодействия металла с агрессивным компонентом среды (сухими газами, неэлектролитами) по реакции Ме+x→Ме x. Электрохимическая коррозия – процесс самопроизвольного разрушения металла в результате электрохимических реакций, скорость которых определяет скорость коррозии:
- а) анодной реакции – перехода ионов металла Ме + в раствор с оставлением эквивалентного количества n электронов е в металле; Ме–nе→Меn+ , определяющей материальные потери при коррозии;
- б) катодной реакции – процесса восстановления окислительных компонентов среды D (Н + , О 2 , Сl2, Br2, NО – 3 и др.) за счет присоединения появившихся в металле избыточных электронов (процесс деполяризации D+ ne→(Dne);
- в) процесса перетекания электронов по металлу и соответствующего перемещения катионов (+) и анионов ( – ) в растворе, т. е. коррозионного тока.
В подавляющем большинстве сред процесс коррозии является электрохимическим.
По виду коррозионных разрушений различают
- общую (сплошную) коррозию (равномерную, неравномерную, избирательную);
- местную (локализованную в виде язв, точек, под поверхностью, межкристаллитную);
- растрескивание под действием статических и циклических нагрузок.
Особенности общей электрохимической коррозии сварных соединений связаны с электрохимической неоднородностью двух видов:
- а) макронеоднородностью, обусловленной различием химического состава и структуры в разных зонах соединения;
- б) микронеоднородностью, обусловленной структурной и химической неоднородностью в пределах каждой зоны (рис. 3).
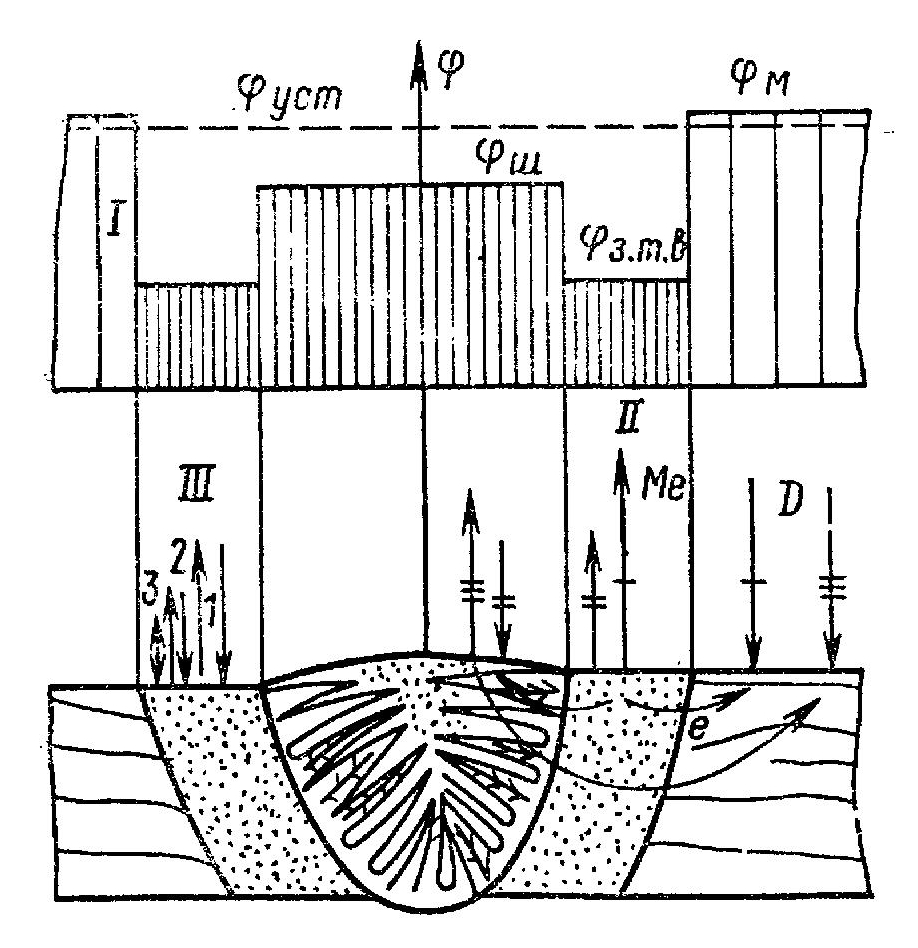
Рис. 3. Схемы коррозии сварного соединения: I – характерное распределение начальных макропотенциалов в сварном соединении; φш – электродный потенциал шва; φзтв – электродный потенциал зоны термического влияния; φм – электродный потенциал основного металла; φуст – установившийся стационарный потенциал заполяризованной системы шов – зона термического влияния (з.т.в.) – основной металл; II – макроэлектрохимическая коррозия, макропара основной металл– зона термического влияния, макропара зона термического влияния – шов, макро- пара основной металл – шов с зоной термического влияния; III – коррозия саморастворения каждой зоны: 1 – гетерогенный механизм электрохимической коррозии; 2 – гомогенный механизм электрохимической коррозии; 3 – химическая коррозия
Поэтому в коррозионном отношении сварное соединение представляет собой сложную многоэлектродную короткозамкнутую электрохимическую систему, характерными макроэлектродами которой являются шов, зона термического влияния с серией переходных структур, основной металл (табл. 1).
Таблица 1. Электродные потенциалы различных зон сварных соединений в З%-ном NaCl
Электродный потенциал, мВ
Зона термического влияния
Стали низкоуглеродистые низколегированные
Ручная дуговая, электрод типа Э55
Ручная без присадки,
Аргонодуговая без при- садки
Аргонодуговая без присадки
Макронеоднородность оценивается по величине средних электродных потенциалов φ каждой зоны, микронеоднородность – по величине локальных электродных потенциалов φi в пределах каждой зоны. Показателем макроэлектрохимической неоднородности сварного соединения является разность начальных потенциалов Δφ между зонами. Показателем микронеоднородности каждой зоны служит разброс начальных локальных потенциалов Δφi = φi max – φi min в пределах каждой зоны.
Восприимчивость сварного соединения в целом или какой-либо его зоны к воздействию коррозионных сред и скорости коррозии зависит от общих и локальных электродных потенциалов и поляризуемости. Чем отрицательнее потенциалы и больше их разность, тем, как правило, больше скорость коррозии.
В зависимости от значений Δφ и Δφi возможны следующие характерные случаи общей коррозии сварных соединений:
- а) Δφ>0,Δφi→, – коррозия по преимущественно макрогетерогенноэлектрохимическому механизму. Определение Δφ и Δφi позволяет в первом приближении судить о неустойчивости различных зон и всего соединения в целом;
- б) Δφ→0,Δφi>0 – коррозия по преимущественно микроэлектрохимическому механизму;
- в) Δφ>0,Δφi>0 – смешанный механизм коррозии.
Общая (сплошная) электрохимическая коррозия характерна для сварных конструкций из углеродистых и низколегированных сталей в большинстве природных сред (атмосфере, водных средах, почве).
Местные избирательные виды коррозии характерны для сварных соединений высоколегированных сталей и цветных металлов в средах, в которых металл находится в пассивной и пассивно-активной области. Межкристаллитная коррозия, связанная со структурными изменениями в сталях, характерна при воздействии на них нагрева до критических температур 450 – 900°С для аустенитных и выше 900°С для высокохромистых ферритных сталей. Примером является межкристаллитная коррозия сварных соединений аустенитных хромоникелевых сталей. Разрушение развивается в трех зонах:
- в основном металле, нагреваемом при сварке до 500 – 900°С,
- в сварном шве
- и в основном металле вблизи линии сплавления в узкой зоне, нагреваемой до температур свыше 1200 – 1250°С (ножевая коррозия).
Преимущественное разрушение границ зерен обусловлено электрохимической неоднородностью металла, возникающей при определенных для каждого сплава температурно-временных условиях в связи с выделением избыточных фаз. Если избыточные фазы образуют протяженные цепочки по границам зерен, то коррозионное разрушение приобретает чрезвычайно опасный межкристаллитный характер. Наиболее характерными избыточными фазами коррозионно-стойких сталей, практически постоянно в них присутствующими, являются карбиды. В зависимости от химического состава стали и условий термического воздействия на них образуются карбидные фазы следующих типов: МС (М≡ Тi, Nb, W, Zr, Ta); М2С (М≡ W, Мо); М3С (на основе железа); М7С3 и М23С6 (на основе хрома), М’nМ”mС (М’≡ Fe, Ni, Со, Si, M”≡ W, Мо, Та, V, Cr, Nb); часто n+m = 6; М12С. Наряду с карбидными возможно образование других фаз, представляющих собой соединения компонентов стали с неметаллами (нитриды, карбонитриды, сульфиды, бориды и др.), а также интерметаллидных фаз (σ, χ), ряд фаз типа Лавеса (Fe2Мо, Fe2W, Fe2Nb), упрочняющих фаз (M3Ti, М3Al) и др.
Принципиальная схема влияния температурно-временных условий на выделение карбидов и межкристаллитную коррозию показана на рис. 4. Температуры ≤850°С благоприятны для преимущественного выделения M23C6 (кривая 1). Ножевая коррозия связана с выделением цепочки карбидов стабилизирующих элементов (МС) под действием высоких температур (> 1200 – 1250°С) по границам зерен (околошовной зоны). Так как скорость коррозии (кипящая 56% HNO3) карбида титана примерно в 1000 раз, а карбида ниобия в 3 – 4 раза больше, чем скорость коррозии стали, то происходит избирательное растворение частиц карбидов, расположенных по границам зерен при катализирующем действии этого процесса на растворение прилегающих участков стали. Дополнительное тепловое воздействие в области критических температур (наложение второго шва) приводит к выделению карбидов хрома (M23C6), что усложняет механизм ножевой коррозии и повышает ее скорость. В окислительных средах кислотостойкие хромоникелевые стали, стабилизированные титаном, менее стойки, чем стабилизированные ниобием, которые, в свою очередь, менее стойки, чем с низким содержанием углерода.
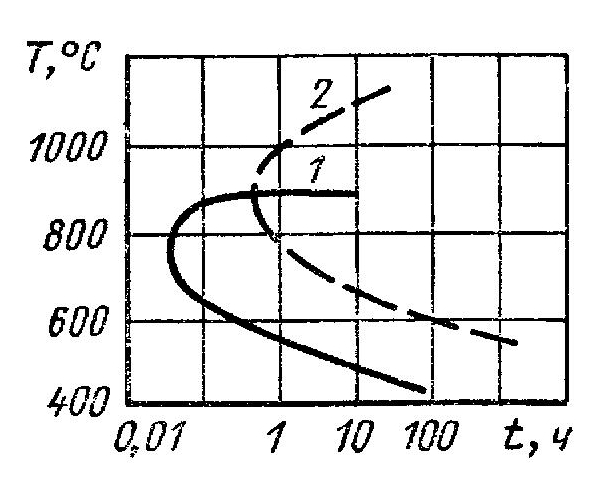
Рис. 4. Границы выделения карбидов типа M23C6(1) и МС (2) у сталей типа 12Х18Н10Т, нагретых до 1250°С, в зависимости от температурно-временных условий
Межкристаллитная коррозия алюминиевых сплавов также связана с выпадением избыточных (интерметаллидных) фаз типа CuAl2, Mg2Al3, MgZn2 и др.
Точечная коррозия типична для пассивирующихся металлов (хром, алюминий, хромо-никелевые стали и др.) и возникает в результате повреждения в отдельных участках пассивной пленки. В сварных соединениях точечной коррозии подвержена преимущественно зона термического влияния.
Коррозионное разрушение сварных соединений в напряженном состоянии.
Напряженное состояние влияет на коррозионное поведение металла вследствие:
- а) сообщения металлу добавочной энергии, в связи с чем иону Me+ легче покинуть решетку деформированного металла по сравнению с недеформированным;
- б) нарушения под действием деформации сплошности и защитных свойств поверхностных пленок;
- в) повышения степени неоднородности, связанной с появлением под действием деформаций дефектов кристаллической решетки и новых анодных фаз.
Скорость коррозии q относительно мало изменяется под влиянием упругих напряжений в нейтральных и щелочных средах, но может заметно (в 2 – 3 раза) увеличиваться в кислых средах пропорционально напряжениям: q=q+ασ, где q – скорость без растягивающих напряжений; α – коэффициент пропорциональности. Незначительно влияя на общую коррозию, напряжения интенсифицируют местные виды коррозии, наиболее опасными из которых является растрескивание, вызываемое статическими нагрузками, и коррозионная усталость при циклическом нагружении.
Коррозионное разрушение в напряженном состоянии определяется коррозионными, механическими и сорбционными процессами, а также сопутствующими процессами (кавитация, радиация). Коррозионное растрескивание состоит из двух основных периодов:
- а) зарождения трещины или инкубационного периода (tэ), в течение которого на металлической поверхности под влиянием локализации коррозионного процесса и растягивающих напряжений происходит зарождение первичных коррозионно-механических трещин;
- б) периода развития трещины (tр), который, в свою очередь, определяется временем докритического (субкритического) роста трещины до ее критических размеров, после чего происходит лавинообразное разрушение.
Скорость субкритического роста коррозионных трещин в зависимости от материала, напряжений и среды изменяется в пределах .10 – 1О – 5 мм/ч.
Постоянное разрушение пленки и интенсивное перемещение раствора при циклическом нагружении может резко повысить скорость разрушения при коррозионной усталости по сравнению с коррозионным растрескиванием.
Разрушения вызываются растягивающими напряжениями. Для большинства сочетаний металл – среда имеются пороговые значения напряжений σпор, ниже которых растрескивание не имеет места вообще или на определенной базе испытаний (рис. 5). Пороговые напряжения варьируются в пределах (0,2 – 1) σт (табл. 2). Сварные соединения растрескиваются интенсивнее по сравнению с основным металлом в связи с воздействием сварочного процесса. Остаточные сварочные напряжения без внешней нагрузки могут вызывать интенсивное растрескивание (рис. 5, б). В средах, вызывающих растрескивание, действие остаточных напряжений и напряжений от внешней нагрузки суммируется (рис. 5, в).
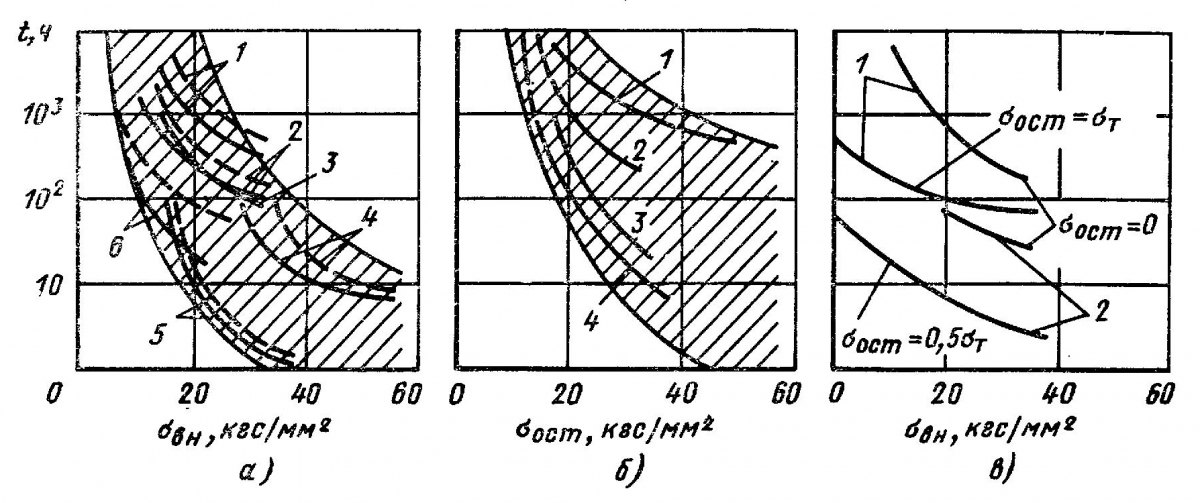
Рис. 5. Влияние напряжений и вида напряженного состояния на коррозионное растрескивание в различных средах (сплошные линии – сварное соединение, штриховые – основной металл):
а – σвн > 0, σост= 0; 1, 4 – одноосный изгиб; 2 – двухосный изгиб, 3, 5 , 6 – одноосное растяжение; 1, 2, 3 – 12Х18Н10Т; 4 – ОТ4; 5 – СтЗсп; 6 – АМг6;
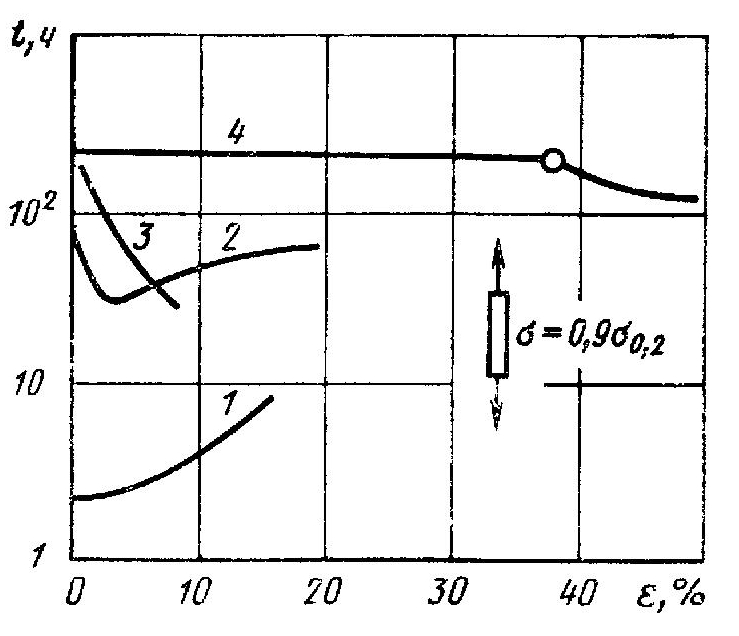
Рис. 6. Влияние предварительной пластической деформации растяжением на время до коррозионного растрескивания стали СтЗсп (1), 12Х18Н10Т (2), сплава АМг6 (3) и деформации сжатием сплава АМг6 (4). Коррозионные испытания при постоянной нагрузке σ= 0,9σт
Влияние пластической деформации на коррозионное разрушение не однозначно (рис. 6), так как в результате пластической деформации могут возникать как благоприятные, так и неблагоприятные изменения свойств металла и напряженного состояния. К неблагоприятным относятся:
- а) повышение внутренней энергии металла;
- б) возникновение при деформации анодных фаз, дефектов решетки, микро- и макронарушений поверхности и структуры, сопровождающихся увеличением и концентрацией напряженности II рода;
- в) возникновение при неравномерной пластической деформации собственных растягивающих напряжений I рода.
Процессами, способствующими повышению стойкости, являются:
- а) уменьшение, перераспределение и снятие в процессе деформации собственных напряжений I рода, а также возникновение сжимающих напряжений на поверхности;
- б) более равномерное распределение анодных участков, что уменьшает локализацию коррозионного разрушения.
В зависимости от металла и среды, деформационно-силовой схемы, степени деформации и термодеформационных условий превалируют те или иные процессы и имеет место увеличение или уменьшение стойкости металла. Отрицательное влияние концентраторов особенно резко- проявляется в средах, в которых металл находится в пассивном или активно-пассивном состоянии. С увеличением агрессивности сред влияние концентратора ослабевает. Чем выше уровень напряженности, тем сильнее проявляется влияние концентраторов при относительно меньшем влиянии среды,
Таблица 2. Ориентировочные значения отношения пороговых напряжений к пределу текучести некоторых материалов в характерных средах, вызывающих их растрескивание
Коррозионные испытания сварных соединений
Установки для автоматической сварки продольных швов обечаек – в наличии на складе!
Высокая производительность, удобство, простота в управлении и надежность в эксплуатации.
Сварочные экраны и защитные шторки – в наличии на складе!
Защита от излучения при сварке и резке. Большой выбор.
Доставка по всей России!
Сварные соединения из углеродистых, легированных и высоколегированных сталей, работающие в условиях химически активной среды, подвержены коррозии (разъеданию).
По своему действию на металл коррозию разделяют на химическую и электрохимическую.
Химическая коррозия представляет собой процесс непосредственного химического взаимодействия между металлом и средой, как, например, окисление железа на воздухе при высоких темпера турах с образованием окалины.
Электрохимическая коррозия — это разрушение металла с участием электрического тока, который возникает при работе металла в воде, растворах кислот, солей и щелочей.
Различают два вида коррозии: общая и межкристаллитная.
При общей коррозии вся поверхность металла или часть его химически взаимодействует с агрессивной средой. С течением времени поверхность разъедается и толщина металла соответственно уменьшается.
При межкристаллитной коррозии происходит разрушение металла по границам зерен. Внешне металл не меняется, но связь между зернами значительно ослабевает, и при испытании на изгиб в растянутой зоне образца образуются трещины по границам зерен.
Испытывая сварные соединения на коррозионную стойкость, сварные образцы (для ускорения процесса испытания) подвергают действию более сильных коррозионных сред, чем те, в которых конструкцию будут эксплуатировать.
Оценку стойкости сварных соединений против общей коррозии проводят несколькими методами.
Весовой метод заключается во взвешивании сварных образцов размером 80 X 120 мм и толщиной 6—10 мм со швом посредине до и после испытания и определении потерь в весе (в г/м 2 ) за определенное время. Усиление шва снимают. Перед испытанием образцы взвешивают с точностью до 0,01 г и замеряют их общую поверхность по всем шести граням. Затем образцы кипятят несколькими циклами по 24—48 ч в азотной или серной кислоте соответствующей концентрации в зависимости от условий работы сварного соединения.
После кипячения с образцов мягкими скребками из дерева, алюминия или меди полностью удаляют продукты коррозии и образцы снова взвешивают. Вычитая вес образца после испытания из первоначального веса и отнеся разность к общей площади поверхности образца (в м 2 ) и одному часу испытания, получают показатель коррозии по потере веса в г/м 2 *ч и пересчитывают его на потерю веса в г/м 2 *год.
Скорость проникания коррозии П в мм/год определяют по формуле
где К — потеря веса, г/м 2 *год;
δ — плотность металла, г/см 3 .
Полученные расчетные данные сравнивают с данными ГОСТа.
По ГОСТ 13819—68 оценку коррозионной стойкости черных и цветных металлов, а также их сплавов при условии их равномерной коррозии проводят по десятибалльной шкале коррозионной стойкости (табл. 15).
Таблица 15. Десятибалльная шкала коррозионной стойкости

Коррозионную стойкость металлов при скорости коррозии 0,5 мм/год и выше оценивают по группам стойкости, а при скорости ниже 0,5 мм/год — по баллам.
Этой шкалой нельзя пользоваться при наличии в металле межкристаллитной коррозии и коррозионного растрескивания.
Профилографический метод состоит в определении степени коррозирования (глубины разъедания) различных участков сварного соединения (основного металла, зоны термического влияния и металла шва). Образцы испытают в среде, аналогичной по действию той, в которой будет работать сварное соединение, но более быстродействующей с определенным коэффициентом ускорения. Глубину разъедания измеряют с помощью специальных профилографов и профилометров (рис. 116), после чего на бумаге вычерчивают профиль сварного соединения после коррозии.
При электрохимическом (потенциометрическом) методе определяют разность потенциалов в той или иной коррозионной среде между сварным швом, зоной термического влияния и основным металлом. Это дает довольно правильные представления о направлении процесса коррозии.
Объемный метод применяют для коррозионных испытаний только основного металла. Он заключается в определении количества газов, образующихся в результате коррозии.
При методе определения коррозионной стойкости по изменению механических свойств для испытания подбирают сильно действующую среду, как, например, раствор серной или соляной кислоты. Образцы выдерживают в коррозионной среде определенное время, а затем подвергают механическим испытаниям, по результатам которых судят о стойкости сварных швов против коррозии.
Качественную оценку коррозионных поражений проводят внешним осмотром, а также исследованием с помощью лупы или микроскопа сварных соединений после коррозионных испытаний. Эта оценка служит дополнением к методам количественной оценки коррозионных поражений.
Межкристаллитной коррозии подвержены главным образом аустенитные и аустенитно-ферритные нержавеющие стали с большим содержанием хрома.

Рис. 116. Определение коррозионной стойкости шва профилометром
а — общий вид профилометра; б — образцы для испытаний: 1 — после сварки; 2 — перед испытанием; 3 — после испытания; в — профиль сварного соединения: I — до испытания; II — после испытания; г — глубина проникания коррозии
При сварке этих сталей отдельные участки основного металла, расположенные по обе стороны от шва, подвергаются действию температур, которые могут вызвать распад твердого раствора и выпадение карбидов железа и хрома на границах зерен. Снижение содержания хрома приводит к потере коррозионной стойкости металла и развитию межкристаллитной коррозии (рис. 117), которая может поразить также участки шва, подверженные повторному воздействию сварочного нагрева.

Рис. 117. Межкристаллитная коррозия в результате выпадения карбидов а — при сварке пересекающихся швов; б — при возобновлении сварки шва после смены электрода; в — при двустороннем сварном шве
Испытания на межкристаллитную коррозию аустенитных, аустенитно-ферритных и аустенито-мартенситных коррозиестойких сталей проводят по ГОСТ 6032—58*.
Образцы (рис. 118) вырезают механическим способом. Контрольную поверхность толщиной до 10 мм состругивают на глубину до 1 мм. Образцы толщиной более 10 мм вырезают поперек шва с таким расчетом, чтобы толщина его была 5 мм, а ширина равнялась толщине основного металла. Чистота поверхности образцов перед испытанием должна быть не ниже Δ7.

Рис. 118. Образцы для испытания на межкристаллитную коррозию
а — при толщине металла до 10 мм; б — при толщине металла более 10 мм; S — толщина металла: I — место вырезки образца; II — контрольная поверхность; III — отход
Склонность металла к межкристаллитной коррозии определяют по методам A, AM, В:
А — в водном растворе медного купороса и серной кислоты;
AM — в водном растворе медного купороса и серной кислоты в присутствии медной стружки;
В — в водном растворе медного купороса и серной кислоты с добавкой цинковой пыли.
Все испытания проводят в колбе или специальном бачке из хромоникелевой стали с обратным холодильником. В реакционный сосуд загружают образцы и заполняют его соответствующим раствором на 20 мм выше образцов. Затем образцы кипятят в растворе: для метода А – 24 ч, AM – 15 или 24 ч; В – 144 ч.
После кипячения образцы промывают, просушивают и загибают на угол 90°. При этом радиус закругления губок или оправки должен быть равен: при толщине образцов до 1 мм — 3 мм, от 1 до 3 мм – не более трехкратной толщины образца и свыше 3 мм — 10 мм.
Поверхность в зоне изгиба образца тщательно осматривают с помощью лупы при увеличении в 8—10 раз. Если на поверхности будут обнаружены поперечные трещины, то это значит, что металл склонен к межкристаллитной коррозии и непригоден для эксплуатации.
Кроме методов A, AM и В существуют еще методы Б и Д.
При методе Б производят анодное травление участков поверхности деталей или зоны термического влияния. Металл сварного шва этим методом не контролируют. Метод Б основан на анодной поляризации и состоит в воздействии коррозионной среды и электрического тока на поверхность испытуемой детали.
Сосуд для коррозионной среды (рис. 119) состоит из свинцовой воронки с резиновой манжетой, плотно прилегающей к поверхности контролируемой детали. Для испытаний собирают установку по схеме, приведенной на рис. 120.

Рис. 119. Сосуд для испытания анодным травлением
а — горизонтальных поверхностей; б — вертикальных поверхностей; I — свинцовая воронка; 2 — резиновая манжетка; 3 — поверхность контролируемой детали

Рис. 120. Электрическая схема для испытания методом анодного травления
1 — источник постоянного тока; 2 — амперметр с ценой деления не более 0.1 а; 3 — реостат или магазин сопротивления; 4 — выключатель; 5 — свинцовый сосуд; 6 — резиновая манжета; 7 — контролируемый образец
Испытания проводят по обеим сторонам сварного шва в шахматном порядке, а в случае перекрытых швов — во всех местах перекрещивания (рис. 121). Поверхность контролируемых участков шлифуют наждачной бумагой и промывают чистым авиационным бензином и спиртом. На отшлифованную поверхность плотно устанавливают сосуд и наливают в него 3—5 мл электролита (60% серной кислоты и 0,5% уротропина), включают электрический ток и в течение 5 мин подвергают металл коррозированию. Полярность устанавливают таким образом, чтобы испытуемое изделие служило анодом, а свинцовый сосуд — катодом. С помощью реостата устанавливают ток плотностью 0,65 а/см 2 при напряжении 5—9 в.

Рис. 121. Схема проведения контроля перекрывающихся сварных швов методом анодного травления
1 — сварной шов; 2 — место анодного травления
По прошествии 5 мин ток выключают, детали промывают водой и протирают спиртом. Образовавшиеся пятна на поверхности образца рассматривают под микроскопом при увеличении не менее чем в 30 раз. При контроле готовых сварных конструкций, когда применение микроскопа невозможно, допускается применение бинокулярной лупы или оптических трубок с 20-кратным увеличением. Если пятно анодного травления имеет однородный светлый или темный цвет, то это значит, что металл не склонен к межкристаллитной коррозии. Браковочным признаком является образование в нем непрерывной сетки.
По методу Д образцы испытывают в кипящей 65% ной азотной кислоте. Перед испытанием образцы взвешивают на аналитических весах с точностью до 0,1 мг. Затем их помещают в стеклянную колбу с обратным холодильником, заливают кислотой из расчета не менее 9 мл кислоты на 1 см 2 поверхности образца и кипятят в течение 48 ч.
Всего проводят три цикла кипячения (каждый раз в новом растворе), промывая, просушивая, обезжиривая и взвешивая образцы после каждого цикла. Коррозионную стойкость определяют по скорости коррозии образцов, выраженной в мм/год за каждые 48 ч. Если скорость коррозии превысит 2 мм/год или будет иметь место ножевая коррозия, металл бракуют.
Л.П. Шебеко, А.П. Яковлев. “Контроль качества сварных соединений”


